三种土壤湿度状况下烟草孢囊线虫侵染特征比较
 计划项目(lj20141811)
计划项目(lj20141811)
作者简介:许冠堂(1994-),男,本科,从事孢囊线虫研究。E-mail:2389996818@qq.com。*通信作者,E-mail:hhzhao@qau.edu.cn
收稿日期:2016-02-17 修回日期:2016-07-18
河南两省,在山东省发生普遍[5]。烟草孢囊线虫病对烟草的损害程度除取决于烟草品种抗性和线虫群体密度外,还受温湿度等环境因素的影响[2,6-7]。线虫在土壤中的活动离不开水,其存活、孵化和侵入均受土壤水分的影响[8]。本项目组研究表明,在烟草生长期阶段性长期(1~2个月)过度浇水明显抑制烟草孢囊线虫(H. glycines)的侵染[9],但土壤水分不足对烟草孢囊线虫的侵染有何影响尚未测定。故而设计本试验,拟在探讨低、中、高3种土壤湿度下烟草孢囊线虫的侵染特征,为其综合治理水分管理这一农业防控措施的实施提供科学依据。
1 材料与方法
1.1 材料来源
用于接种的线虫群体为侵染烟草的大豆孢囊线虫(Heterodera glycines),在此缩写为HGT,采自山东省诸城市辛兴镇烟叶农场。烟草品种为中烟100,由中国农科院烟草研究所提供。烟草定植器采用容积为210 mL的聚丙烯水杯,杯高8.5 cm。
1.2 线虫接种
2015年5月7日,60个水杯装砂壤土,装土量150 g/杯,然后每杯移栽1株3~4片真叶烟苗,充分浇水后置温室内在22~32 ℃下缓苗。5 d后当水杯土壤体积含水量降至5%时接种HGT:在烟株周围土壤上用玻璃棒打3个孔,孔深至烟草根系水平,孔内分别置入3、3和4个大小一致的饱满孢囊(接种前先将孢囊刺破,以便于日后调查时新生孢囊的甄别),压土封孔。每杯共接种孢囊10个,即HGT初始孢囊群体密度(Pi)为6.7个/100g土壤。
1.3 土壤湿度处理和烟株培养
2015年5月12日接种孢囊后,立即对杯土进行3种土壤湿度处理,处理数量为每处理20 杯。低湿度处理:不浇水,保持5%的体积含水量;中湿度处理:浇水15 mL/杯,使土壤体积含水量达20%;高湿度处理:浇水25 mL/杯,使土壤体积含水量达35%。处理后将杯苗立即放置在光照培养箱中,在12 h光照/12 h黑暗、25 ℃和80% RH下培养35 d。在培养过程中,使用土壤湿度测量仪每隔48 h检测1次杯土湿度并及时补充水分,将低、中和高湿度处理的杯土体积含水量分别控制在3%~9%、15%~25%和30%~40%范围内。
1.4 调查和检测方法
取样:接种线虫后第10、20、30和35天各取1次样,每个处理每次取5杯。将烟草根系上的白色雌虫(如果有)全部抖落到各自杯土中,然后分离各杯土壤中的线虫,并对各杯根组织中的线虫染色。
土样中线虫的分离和计数:采用淘洗-过筛法和淘洗-过筛-贝曼漏斗法分离每个水杯土壤中的白色雌虫、孢囊和2龄幼虫(J2)[10],在解剖镜下对白色雌虫、新生孢囊和J2进行检查并计数。
根组织中线虫的染色和计数:采用次氯酸钠-酸性品红染色法对每个水杯烟草根组织内的线虫进行定量染色[10],在解剖镜和显微镜下对J2、3龄幼虫(J3)和4龄幼虫(J4)进行检查并计数。
1.5 数据统计与分析
计算每100 g土壤中J2和孢囊(新生孢囊+白色雌虫)的数量以及1 g根组织中J2、J3和J4的数量,即不同虫态的群体密度。利用Excel 2003软件对各调查时期的线虫群体密度,即线虫群体动态,进行制图;利用DPS数据处理系统软件(DPS 14.50)中的Duncan新复极差法对试验数据进行统计分析。HGT在3种土壤湿度下侵染水平的评价采用繁殖系数(reproduction factor,Rf)法:Rf =孢囊最终群体密度(Pf)/孢囊初始群体密度(Pi),本试验中Pi为6.7个/100 g土壤。
2 结 果
2.1 HGT 幼虫群体动态
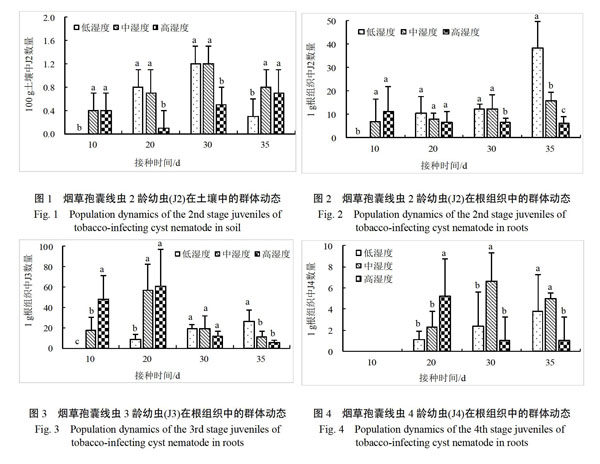
由图1看出,接种线虫后第10天,低湿度处理的土壤中未检测到J2,而中、高湿度处理的土壤中存在J2。接种线虫后第20天,低湿度处理的土壤中出现大量J2,而高湿度处理的土壤中J2群体
密度最小。接种线虫后第30天,低和中湿度处理的土壤中J2群体密度均达其高峰值,而高湿度处理的土壤中也存在较大数量J2(图1)。
由图2看出,接种线虫后第10天,低湿度处理的烟草根组织中未检测到J2,而中和高湿度处理的已出现J2,高湿度处理的J2群体密度最大。接种线虫后第20天,低湿度处理的根组织中才开始出现J2,且J2群体密度最大。接种线虫后第35天,低和中湿度处理的根组织中J2群体密度达其高峰值。接种线虫后第10天和第20天(HGT世代进程的前中期,下同),低、中和高湿度处理的烟草根组织中J2平均群体密度分别为5.3、7.4和8.9个/g根,侵入量依次增加。
由图3看出,接种线虫后第10天,低湿度处理的烟草根组织中未检测到J3,而中和高湿度处理的已出现J3,高湿度处理的J3群体密度最大。接种线虫后第20天,低湿度处理的根组织中才开始出现少量J3。低、中和高湿度处理的根组织中J3发育高峰分接出现在接种后第35天、第20天和第20天。接种线虫后第10天和第20天,低、中和高湿度处理的烟草根组织中J3平均群体密度分别为4.3、37.2和54.7个/g根,J3发育量依次增加。
由图4看出,接种线虫后第10天,3种湿度处理的烟草根组织中均未检测到J4。接种线虫后第20天,3种湿度处理的根组织中均出现J4。低、中和高湿度处理的根组织中J4发育高峰分接出现在接种后第35天、第30天和第20天。接种线虫后第10天和第20天,低、中和高湿度处理的烟草根组织中J4平均群体密度分别为0.6、1.2和2.6个/g根,J4发育量依次增加。
从以上结果可以看出,与中湿度处理相比,低湿度处理下,HGT J2在土壤中的孵化和对根系的侵
入均受到抑制,根组织中J3和J4发育量明显减少且发育进程延迟;高湿度处理下,HGT J2对烟草根系的侵入加快,根组织中J3和J4的发育提前。
2.2 HGT新生孢囊群体动态
由图5看出,接种线虫后第10天,3种湿度处理的烟草土壤中均未检测到新生孢囊(含白色雌虫,下同)。接种线虫后第20天,3种湿度处理的新生孢囊均已出现,高湿度处理的新生孢囊群体密度最大。之后,3种湿度处理的新生孢囊群体密度均呈上升趋势,均于接种后第35天达发生高峰,低、中和高湿度处理的高峰值分别为4.7个、6.8个和2.4个/100 g土壤,即各自湿度处理的HGT孢囊最终群体密度(Rf)。本试验中孢囊初始群体密度(Pi)均为6.7,由此推算,低、中和高湿度处理下HGT的繁殖系数分别为0.7、1.0和0.4。
试验同时发现,3种湿度处理的白色雌虫最大群体密度出现在接种后第30天。
3 讨 论
在20.0和22.2 ℃条件下,大豆孢囊线虫(Heterodera glycines)在大豆上完成1个世代需要22~37 d[11];侵染烟草的大豆孢囊线虫(HGT)在田间烟草上可以完成4个世代,平均世代历期27 d[12]。本研究中,在土壤中湿度(体积含水量15%~25%)下,HGT于接种后第20天出现J3发育盛期,于接种后第30天出现J4发育和白色雌虫形成盛期,并于接种后第30天和第35天分别出现J2土壤孵出和根系侵入高峰,表明于接种后30 d HGT已基本完成了1个世代,符合其世代发生规律。在土壤高湿度(体积含水量30%~40%)下,HGT虽然在前中期有较快的侵入和根内发育,且J3和J4发育量最大,但最终形成的孢囊(或雌虫)却最少,繁殖系数(Rf)不到中湿度下Rf的50%,究其原因,可能由于较长期的高湿胁迫[7,13-14]和/或土壤较长期高湿条件致使烟碱在根系中大量积累而对根内线虫产生毒害作用[9,15],导致根内大部分J4无法成功发育为雌虫。土壤水分过饱和条件下,可造成O2含量过低、CO2大量积累和(或)毒素增加,对线虫和植物产生伤害[16],势必影响线虫的繁殖。例如Singh等[17]研究发现,木豆孢囊线虫(Heterodera cajani)在重量含水量24%下繁殖良好,Rf高达19.4,而在重量含水量40%下繁殖明显受到抑制,Rf仅为0.4。
线虫在土壤中的活动离不开水,土壤干燥势必影响其存活、孵化、移动和侵染。砂质粘壤土当重量含水量为7.2%~13.0%时,肾状肾形线虫(Rotylenchulus reniformis)能够很好侵染大豆,当其为3.4%~5.8%时侵入量明显下降[18];当土壤体积含水量为9.6%时,小麦孢囊线虫(Heterodera avenae)病情指数为88.7,当其为4.7%时病情指数低于60.0[19];我国胶东地区3—4月持续严重干旱,导致非灌溉麦田小麦孢囊线虫群体明显下降[20];大豆生长季前期土壤持续干旱,导致大豆孢囊线虫第1代发生量小而不明显,且与第2代世代重叠严重[21]。从以上研究结果看出,土壤缺水对线虫侵染和繁殖不利;而本研究则进一步表明,土壤低湿度(体积含水量3%~9%)下,HGT的孵化和侵入受到抑制,根内线虫发育延迟,Rf有所下降。此外,从本研究结果可以推测,较长时间土壤高湿比一般性土壤干旱对HGT的抑制效果更加明显,而土壤湿度适中或土壤时而干旱时而潮湿有利于HGT的发生和危害。
参考文献
[1]Nicol J M, Turner S J, Coyne D L, et al. Current nematode threats to world agriculture[C]//Jones J, Gheysen G, Fenol C. Genomics and molecular genetics of plant-nematode interactions. Dordrecht: Springer, 2011: 21-43.
[2]Johnson C S, Way J, Barker K R. Nematode parasites of tobacco[C]//Luc M, Sikora R A, Bridge J. Plant parasitic nematodes in subtropical and tropical agriculture (2nd Edition). Wallingford: CABI Publishing, 2005: 675-708.
[3]程子超,赵洪海,李建立,等. 山东省寄生烟草的孢囊线虫种类鉴定及种内群体间rDNA-ITS-RFLP分析[J]. 植物病理学报,2012,42(4):387-395.
[4]王凤龙,王刚. 图说烟草病虫害防治关键技术[M]. 北京:中国农业出版社,2013:47-48.
[5]程子超,赵洪海,王凤龙. 胞囊线虫在我国烟区的分布及发生世代调查[C]//王凤龙,王刚. 烟草有害生物调查研究与防治实践. 北京:中国农业出版社,2012:24-29
[6]Wang J, Johnson C S, Eisenback J D. Effects of host resistance and temperature on development of Globodera tabacum solanacerum[J]. Journal of Nematology, 2001, 33(2-3): 132-136.
[7]赵洪海,丁海燕,王凤龙. 大豆和烟草上大豆孢囊线虫田间侵染特征比较分析[J]. 中国农业科学,2014,47(22):4417-4425.
[8]刘维志. 植物病原线虫学[M]. 北京:中国农业出版社,2000:89-93.
[9]董秋月,郑玉华,赵洪海. 土壤水分对烟草孢囊线虫侵染和烟碱含量的影响[J]. 中国烟草科学,2015,36(5):64-68.
[10]段玉玺. 植物线虫学[M]. 北京:科学出版社,2011:199-213.
[11]王振华,时立波,吴海燕,等. 大豆根内胞囊线虫发育进程及分布[J]. 中国农业科学,2009,42(9):3147-3153.
[12]赵洪海,程子超,王凤龙. 山东省烟草孢囊线虫的群体动态和世代发生特点[J]. 植物保护学报,2103,40(6):529-532.
[13]Heatherly L G, Young L D, Epps J M, et al. Effect of upper-profile water potential on numbers of cysts of Heterodera glycines on soybean[J]. Crop Science, 1982, 22(4): 833-835.
[14]Duan Y X, Zheng Y N, Chen L J, et al. Effects of abiotic environmental factors on soybean cyst nematode[J]. Agricultural Sciences in China, 2009, 8(3): 317-325.
[15]Yu Q, Potter J W. Selective nematicidal activity of nicotine[J]. Journal of Food, Agriculture & Environment, 2008, 6(3 & 4): 428-432.
[16]Sardanelli S, Kenworthy W J. Soil moisture control and direct seeding for bioassay of Heterodera glycines on soybean[J]. Journal of Nematology, 1997, 29(4S): 625-634.
[17]Singh M, Sharma S B. Infectivity, development, and reproduction of Heterodera cajani on pigeonpea: influence of soil moisture and temperature[J]. Journal of Nematology, 1995, 27(3): 370-377.
[18]Rebosis R V. Effect of soil water on infectivity and development of Rotylenchulus reniformis on soybean, Glycine max[J]. Journal of Nematology, 1973, 5(4): 246-249.
[19]杨卫星,袁虹霞,邢小萍,等. 土壤质地组分及含水量对小麦禾谷胞囊线虫病发生的影响[J]. 河南科学,2008,26(6):672-675.
[20]赵洪海,丁海燕,彭德良. 胶州市小麦禾谷孢囊线虫群体动态的年度间差异[J]. 麦类作物学报,2014,34(4):563-567.
[21]齐娜伟,赵洪海. 2014 年气象条件对大豆孢囊线虫田间侵染进程的影响分析[J]. 山东农业科学,2015,47(5):81-85.
热门文章:
- 新思想奋进新时代学习心得感受优选4篇2025-01-12
- 六稳六保学习心得体会7篇2025-01-12
- 幼儿园2023年度国庆节主题活动方案3篇2025-01-12
- 保持师德演讲稿甄选3篇2025-01-12
- 防网络诈骗学习心得体会通用范文选集5篇2025-01-12
- 在2023年全市模范机关建设工作推进会上的发言5篇2025-01-12
- 欢庆国庆节幼儿园的活动方案6篇2025-01-12
- 万名党员进党校培训班职工心得感想3篇2025-01-12
- 新任职领导表态发言稿9篇2025-01-12
- 长征精神学习心得体会13篇2025-01-12
相关文章:
